جدول المحتويات
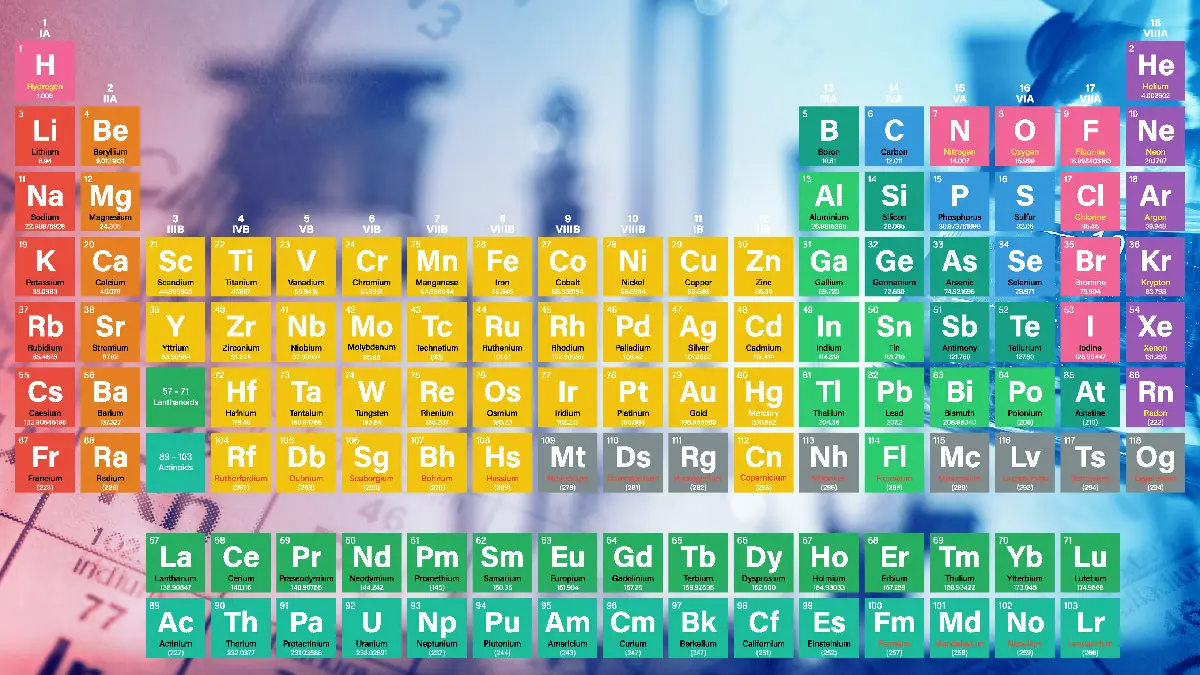
يبلغ عدد عناصر الجدول الدوّري 118 عنصر، تختلف في خصائصها الكيميائية والفيزيائية، وتمّ ترتيبها اعتماداً على الوزن الذرّي لكل عنصر، وتمّ تقسيم الجدول الدوري إلى سبع صفوف تدعّى الدورات، أيضاً ثماني أعمدة تدعّى مجموعات، ولكل عنصر عدد ذرّي يكتب أسفل رمز العنصر، وعدد كتلي يكتب أعلى رمز العنصر مختلف عن باقي العناصر، وتنقسم العناصر في طبيعتها إلى عناصر فلّزية، وشبه فلزّية، وعناصر لا فلزّية.
يتحدث المقال عن الجدول الدوري للعناصر الكيميائية، ويشمل:
- تعريف الجدول الدوري، وتاريخه.
- شرح الجدول الدوري، وخصائصه، وطريقة حفظه.
- عناصر الجدول الدوري وأسمائها.
- مجموعات الجدول الدوري، واستخداماته.
- اهمية الجدول الدوري التفاعلي.
تعريف الجدول الدوري
يُعتبر الجدول الدوري (بالإنجليزية: The Periodic table) ترتيباً للعناصر وفق عددها الذري تصاعدياُ، واعتماداً على خصائصها الكيميائية، والتي يبلغ عددها 118 عنصر معروف لغاية اللحظة، وينظم الجدول الدوري جميع العناصر الكيميائية المكتشفة في صفوف وأعمدة، وفي عام 1834 نشر العالم الكيميائي الروسي ديمتري مينديليف النسخة الأولى الأحدث للجدول الدوري، حيث قام فيه بترتيب العناصر اعتماداً على الكتل المولية لها (الأوزان الذرية) ذات الخصائص الكيميائية المتشابهة كأعمدة مرقّمة من العدد 1 إلى العدد 18، تتشابه عناصر العمود الواحد (المجموعة الواحدة) في صفاتها الكيميائية، والسبب يعود إلى تساوي عدد الإلكترونات في الغلاف الأخير لكل عنصر منها، والتي تسمى إلكترونات التكافؤ.
تاريخ الجدول الدوري للعناصر الكيميائية
أول تصنيف للعناصر الكيميائية كان العالم لافوازييه، وبلغ عددها ثلاثة وثلاثين عنصراً في عام 1970، وقد فُرزت إلى عناصر فلزات (معادن)، وعناصر لا فلزية (لا معادن)، وفي عام 1828 وضع رمزاً ووزناً ذرياً لكل عنصر موجود في الجدول، وتابع العالم دوبرينر ما بدأه لافوازييه في عام 1829؛ حيث قام بوضع ثلاث مجموعات في ثلاثة جداول، كل منها يضم ثلاثة عناصر متشابهة في الخصائص؛ المجموعة الأولى تحوي: عنصر الليثيوم، والصوديوم، والبوتاسيوم، فيما تضم المجموعة الثانية العناصر التالية: الكالسيوم، والسترونشيوم، عنصر الباريوم، فيما تضم المجموعة الأخيرة العناصر الآتية: عنصر الكلورين، وعنصر البرومين، وأخيراً عنصر اليود.
في عام 1864 قام العالم جون نيولاندز بتصنيف وترتيب العناصر بناءً على وزنها الذري، فقد لاحظ وجود تشابه بين العنصر الأول والتاسع، والعنصر الثاني مع العاشر وهكذا، هذا ما جعله يقدّم قانون باسم أوكتاف يوضح فيه نظريته.
العالم الكيميائي الروسي ديمتري مندليف Dmitri Mendeleev اقترح بناء الجدول الدوري دون معرفة تركيب الذرات الداخلي، وترتيب العناصر بناءً على الكتلة الذرية لكل عنصر، فيمكن ملاحظة التكرارية في خواص العناصر عند تمثيلها مقابل كتلتها الذرية.
بعض النظريات التي لم تلاقي القبول للعالم الكيميائي الإنكليزي جون أليكساندر ريينا نيولاندز عام 1865؛ أن العناصر ذات الخواص المتشابهة تتكرر بدورية مقدارها 8 عناصر.
في عام 1896م، طُوّرَ أول جدول دوري على يد العالم الألماني يوليوس لوثر ماير، والكيميائي الروسي ديمتري إيفانوفيتش ميندليف؛ حيث قاموا بترتيب العناصر وفقاً لكتلتها، وغيّر مندليف أماكن بعضٍ من العناصر، وصحّح أماكنها بصورة أفضل من السابق، وذلك اعتماداً على قيم الكتل الذرية لكل عنصر في الجدول في القرن 19 والقرن 20، وتمّ إثبات صحة نظريات مندليف بعد اكتشاف التركيب الإلكتروني.
شرح الجدول الدوري
الجدول الدوري مع العدد الذري والكتلي
العدد الذري للعنصر في الجدول الدوري يساوي عدد البروتونات للعنصر نفسه، والذي يُرمز له بالحرف “Z”، كما يكون العدد الذري سبباً في تحديد نوع وخصائص كل عنصر، كما أنّ العناصر في الجدول الدوري تترتب اعتماداً على ازدياده، ويكون العدد الكتلي الذي يرمز له بالحرف “A” ناتج عن جمع عدد البروتونات والنيوترونات في ذرة العنصر الواحد، ولا تدخل كتلة الإلكترونات في مجموع العدد الكتلي؛ وذلك لأن كتلة الإلكترونات في ذرة العنصر صغيرة جداً، والتي يمكن أن تكون كتلتها أقل من كتلة البروتون في الذرة الواحدة بِـ 1800 ضعف تقريباً، وعند التعبير عن عنصرٍ ما في الجدول الدوري؛ فإن العدد الكتلي يكتب بخط صغير الحجم، ويوضع على يسار العنصر في الأعلى، أمّا العدد الذري يُكتب بخط صغير الحجم أيضاً، ويوضع على يسار العنصر في الأسفل.
الجدول الدوري القديم
كان العلماء يبدون اهتماماً واضحاً في ترتيب العناصر قديماً، منهم العالم الإنجليزي نيولاندز؛ حيث قام الأخير بترتيب العناصر وتوزيعها اعتماداً على الوزن الذري لكلٍ منها، أيضاً قام العالم الألماني دوبراينر بترتيب العناصر وفقاً للعلاقات والصفات التي تربطها سويةً في تركيبها.
يوجد في الجدول الدوري القديم 63 عنصراً كيميائيّاً، قد رُتِبت في عام 1869 على يد العالم الكيميائي ديميتري مندلييف، وكان ترتيبها آنذاك قد اعتمد على وزن كتلها الذرية لكلٍ منها، وتم ترك فراغات في الجدول من أجل إضافة العناصر التي لم يتم اكتشافها بعد، أيضاً وُجدت وقبل جدول مندلييف اهتمّ العلماء بتوزيع العناصر الكيميائيّة بالاعتماد على أوزانها الذريّة، ومنهم: العالم الإنجليزيّ نيولاندز الذي رتّب كلَّ عنصرٍ وفقاً لازدياد حجم كتلته الذريّة، كما رتّب العناصر بناءً على العلاقات التي تربط بينها، من حيث الصفات المتشابهة في تركيبتها.
في عام 1913م، ظهر جدول العالم الإنجليزي موزلي، والذي قام فيه بإqفاء تحديث على جدول العالم مندلييف تصاعديّاً وتنازليّاً، أيضاً اعتمد في بناء ترتيبه على قيم الكتل الذريّة لكلّ عنصر في الجدول؛ حيث رتب العناصر ترتيباً تصاعدياً وتنازلياً اعتماداً على قيم الكتل الذرية منها.
الجدول الدوري الحديث
الجدول الدوري الحديث يجمع بين مجموعة العناصر المضافة إلى جدول مندلييف التي لم تكن مكتشفة حينها؛ حيث رُتّب الجدول تصاعدياً ويتكوّن من ثمانية عشر عموداً، وسبعة صفوفٍ أفقيّة، أيضا قُسِّم إلى أربعة أقسام: يمين، ويسار، ووسط، ونهاية الجدول. كلُّ قسمٍ يتكون من مجموعة عناصر تتوزع على مجموعات كالآتي: بدايةً القسم اليسار يتكون من عناصر المجموعة (A)، وتتكوّن من المجموعتَين (A1،A2)، ويُطلق عليها اسم الفلزّات القلويّة، ثانياً القسم اليمين والذي يحتوي باقي العناصر المكوّنة للمجموعة (A)، وتتفرّع منها المجموعات (A3 إلى A7)، يطلق عليها أسماء اللافلزّات، وأشباه الفلزات، وباقي الفلزّات الأخرى، والغازات النادرة، أو الخاملة، كما تُسمّى العناصر الموجودة في مجموعة (A7) بالهالوجينات التي تُعرف باسم العناصر التمثيليّة (غير الانتقاليّة). ثالثاً القسم المتوسّط الذي يحتوي على عناصر المجموعة (B)، والتي تتكون من ثلاثين عنصراً تُسمّى بالعناصر غير التمثيليّة (الانتقاليّة)، وآخر قسم يتكوّن من سلسلتَين من العناصر، كلّ منها يحتوي على أربعة عشر عنصر؛ السلسلة الأولى ويطلق عليها اسم اللانثانيدات، وتبدأ بعنصر اللانثانوم والسلسلة الثانية: وتُسمّى الأكتينيدات، وتبدأ بعنصر الأكتينيوم.
خصائص الجدول الدوري
يحتوي الجدول الدوري الحديث على 118 عنصر، ولا يزال البحث جارياً في محاولة لإيجاد عناصر جديدة، معظم العناصر في الجدول الدوري الحديث عبارة عن معادن، ومنها المعادن القلوية، والمعادن القلوية الترابية، أيضاً المعادن الأساسيّة، والمعادن الانتقاليّة؛ يطلق على كلٍ من صفوف الجدول الدوري اسم الدور؛ أي مستوى طاقة الإلكترونات غير المهيّجة.
عند الانتقال من اليسار إلى اليمين في الدورة الواحدة، يقل حجم الذرة، كما يزداد عند الانتقال من الأعلى إلى الأسفل في المجموعة الواحدة، كما تتشابه عناصر المجموعة الواحدة بالخصائص، كما لها نفس ترتيب إلكترونات المدار الأخير، ومن خصائص العناصر ما يلي: عناصر المجموعة الأولى والثانية والثالثة أنّها تميل لفقد الإلكترونات، وتصبح أكثر كهرإيجابية، أمّا بالنسبة إلى عناصر المجموعة الرابعة والخامسة والسادسة، فإنّها تميل لكسب الإلكترونات، وتصبح أكثر كهروسلبية.
العناصر الخاملة (الغازات النبيلة)؛ وهي التي تنتهي بها كل دورة في الجدول الدوري، وتتميّز بأنّ الكترونات مدارها الأخير (إلكترونات التكافؤ) التي تحدد رقم الدورة الذي ينتمي إليها العنصر تكون ممتلئة، وتوجد سلسلتان من العناصر التي تقع في أسفل الجدول الدوري؛ تسمى السلسلة الأولى لانثانيدات، والسلسلة الثانية تسمى أكتينيدات، وعددها 14 عنصر في كل سلسلة، كما تنتمي هذه السلاسل إلى مجموعة العناصر الانتقالية، وضعت في أسفل الجدول الدوري لتوفير المساحة، وتصنّف العناصر في الجدول الدوري إلى فلزات ولا فلزات، يقسم بينهما أشباه الفلزات، وتقل الكهروسلبية كلما انتقلنا من يمين إلى يسار العناصر في الجدول الدوري.
عناصر الجدول الدوري
رتِّبت عناصر الجدول الدوري في جدول يتكون من ثماني أعمدة تسمى بالمجموعات، وسبعة صفوف تسمى بالدورات، وكانت طريقة ترتيبها تعتمد على العدد الذري، ليس ذلك فحسب؛ بل اعتمدت أيضاً على عدد الالكترونات في المدار الأخير من غلاف نواة كل عنصر؛ حيث إنه وبناءً على قاعدة الثمانية (بالإنجليزية: Octet Rule)، تتحد العناصر مع بعضها لملىء الغلاف الأخير إلى ثماني إلكترونات، وبهذا يصبح الغلاف كاملاً؛ ما يجعل العنصر في حالة استقرار أكثر، لكن لا تنطبق هذه القاعدة على جميع العناصر، إلّا أنها الأساس في ترتيب العناصر داخل الجدول الدوري.
عدد عناصر الجدول الدوري
تقسم عناصر الجدول الدوري إلى مجموعتين هما:
- العناصر الطبيعيّة والشائعة وعددها 90 عنصر، وتقسم إلى:
- المعادن مثل: الذهب، والحديد.
- أشباه الفلزّات مثل: السيلينيوم، والزرنيخ.
- اللافلزّات مثل: الفسفور، والكربون.
- العناصر الأرضيّة النادرة: عددها 17 عنصر؛ 15 عنصر منها من اللانثانيدات، بالإضافة إلى عنصر الإتريوم، وعنصر السكانديوم.
اول عنصر في الجدول الدوري
عنصر الهيدروجين Hydrogen ورمزه الحرف H، هو أول عنصر في الجدول الدوري وعدده الذري يساوي واحد.
العناصر الانتقالية في الجدول الدوري الحديث
تنتشر العناصر الكيميائيّة في القشرة الأرضيّة، ومن أكثر العناصر الموجودة فيها عنصر الحديد، ويليه عنصر الألومنيوم، وهناك أيضاً بعض العناصر الانتقاليّة المهمّة، كما تعتبر التنغستن، والبلاتينيوم، والذّهب، والفضّة؛ من العناصر التي تتواجد بكمياتٍ قليلةٍ في القشرة الأرضيّة، أيضا عنصر التكنيشيوم هو العنصر الوحيد لم يتم عزله عن القشرة الأرضية، إلّا بكميات قليلة ومعقولة؛ حيث إنّ جميع نظائر هذا العنصر إشعاعيّة.
اكتُشفت في العصور القديمة أربعة عناصر انتقاليّة، وهي: الحديد، والنّحاس، والفضّة، والذّهب في العصور القديمة، وفي أوائل القرن الثامن عشر تمّ اكتشاف باقي العناصر الانتقاليّة، ثم عنصر الرينيوم؛ وهو أحدث العناصر الانتقاليّة التي تمّ بين خامات البلاتينيوم في عام 1925.
تمتلك العناصر الانتقاليّة بعض الصفات التي تميّزها عن غيرها من العناصر، ومن هذه الخصائص الصلابة والقوّة؛ وهو التشابه المميّز بين العناصر الانتقالية الأربع جميعها، أيضاً اللمعان؛ حيث إنّ معظم المعادن تكون إمّا بيضاء، أو مائلة إلى اللون الرمادي مثل: الحديد والفضّة، بينما النحاس والذهب؛ فلهما ألوان مميزة غير موجودة بين العناصر الأخرى بالجدول الدوري، أيضاً تتّصف العناصر الانتقاليّة بدرجة غليانها، وانصهارها العالية، فيما عدا عنصر الزئبق الذي يكون سائلاً بنفس درجة حرارة الغرفة.
من صفات بعض العناصر الانتقاليّة أيضاً المرونة؛ أيّ يسهل طرقها وثنيها، ثمّ إعادة تشكيلها، كما أنها تمتلك طاقة تأيّن قليلة، كذلك العناصر الانتقاليّة من الموصلات الجيّدة للحرارة والكهرباء، ذلك لمدى توافق هذه الخصائص بشكل كبير، وتستخدم بعض العناصر الانتقالية في بعض المجالات المختلفة؛ فمثلاً يدخل كل من الحديد، والنيكل، والنحاس، والتيتانيوم؛ في مجال البناء، أيضاً مجال تكنولوجيا الكهرباء، بالإضافة إلى دخولها تكوين العديد من السبائك مع بعض العناصر الأخرى.
العناصر المشعة في الجدول الدوري
العناصر المشعة في الجدول الدوري هي العناصر غير مستقرة النواة، ذلك بسبب أعداد البروتونات والنيوترونات المتزايدة داخلها، كما تنقسم النواة غير المستقرة إلى جزيئات حتى تصبح نواة مستقرة في تحول يصاحبه انبعاث ثلاثة أنواع من الأشعة وهي: ألفا، وبيتا، وجاما، وفي عام 1896 قام العالم الفرنسي باكتشاف عناصر اليورانيوم والثوريوم، التي استٌخدمت في تشخيص الأمراض المختلفة وعلاجها، أيضاً توليد الطاقة وغيرها من الاستخدامات، ويذكر الجدول التالي أمثلة على العناصر المشعة، وعددها الذرّي، واستخداماتها:
| العنصر المشع | نبذة عنه | العدد الذري | استخداماته |
اليورانيوم U | يميل من اللون الأبيض إلى الفضي، ويتواجد في الصخور | 92 | القواعد العسكرية، والمنشآت التي تعتمد الطاقة النووية في تحلية مياه البحار، وتوليد الكهرباء، أيضاً تقدير عمر الصخور النارية. |
| الفرانسيوم Fr | اكتشفه العالم الفرنسي مارغريت يري عام 1939، من الفلزّات القوية التي تتواجد بصورة نادرة جداً في الطبيعة | 87 | يستخدم في أبحاث علوم الأحياء |
| الراديوم Ra | يضم 26 نظيراً من النظائر المشعة، وهو أثقل الفلزّات القلوية، أيضاً كثير التأكسد حال تعرضه للهواء، عند انقاسمه ينتج عنه غاز الرادون، وعندما يستقر يتحول إلى عنصر الرصاص | 88 | له العديد من الاستخدامات الحديثة مثل: معجون الأسنان، ومستحضرات التجميل |
الروبيديوم Rb | من الفلزّات القلوية الهشّة، سريع التفاعل ويشتعل عن التأكسد في الهواء مباشرةً، لونه أبيض لمّاع يميل إلى الفضة، ويشبه الصوديوم والبوتاسيوم في خصائصه | 37 | أضواء الكشّافات والمرايا، وفي صناعة المجوهرات |
أسماء عناصر الجدول الدوري
اسماء عناصر الجدول الدوري بالعربي
الصف الأفقي في الجدول الدوري يسمى الدورة، ويتكون الجدول الدوري من سبع دورات تختلف خصائصها فيما بينها عند الانتقال باتجاه اليمين في الجدول؛ حيث تزداد طاقة التأين، ويقل نصف قطر الذرة، أيضاَ تزداد الكهروسلبية.
الدورة الأولى
| اسم العنصر | رمز العنصر |
| الهيدروجين | H |
| الهيليوم | He |
الدورة الثانية
| اسم العنصر | رمز العنصر |
| الليثيوم | Li |
| البيريليوم | Be |
| البورون | B |
| الكربون | C |
| النيتروجين | N |
| الأكسجين | O |
| الفلور | F |
| النيون | Ne |
الدورة الثالثة
| اسم العنصر | رمز العنصر |
| الصوديوم | Na |
| المغنسيوم | Mg |
| الألومنيوم | Al |
| السيليكون | Si |
| الفوسفور | P |
| الكبريت | S |
| الكلور | Cl |
| الآرغون | Ar |
الدورة الرابعة
| اسم العنصر | رمز العنصر |
| البوتاسيوم | K |
| الكالسيوم | Ca |
| السكانديوم | Sc |
| التيتانيوم | Ti |
| الفانديوم | V |
| الكروم | Cr |
| المنغنيز | Mn |
| الحديد | Fe |
| الكوبالت | Co |
| النيكل | Ni |
| النحاس | Cu |
| الزنك أو الخارصين | Zn |
| الغاليوم | Ga |
| الجرمانيوم | Ge |
| الزرنيخ | As |
| السيلينيوم | Se |
| البروم | Br |
| الكريبتون | Kr |
الدورة الخامسة
| اسم العنصر | رمز العنصر |
| الروبيديوم | Rb |
| السترونشيوم | Sr |
| الإتريوم | Y |
| الزركونيوم | Zr |
| النيوبيوم | Nb |
| الموليبدنوم | Mo |
| التكنيشيوم | Te |
| الروثينيوم | Ru |
| الروديوم | Rh |
| البالاديوم | Pd |
| الفضة | Ag |
| الكادميوم | Cd |
| الإنديوم | In |
| القصدير | Sn |
| الإِثْمِد | Sb |
| التيلوريوم | Te |
| اليود | I |
| الزينون | Xe |
الدورة السادسة
| اسم العنصر | رمز العنصر |
| السيزيوم | Cs |
| الباريوم | Ba |
| اللوتيشيوم | Lu |
| الهافنيوم | Hf |
| التانتالوم | Ta |
| التنجستن | W |
| الرينيوم | Re |
| الأوزميوم | Os |
| الإريديوم | Ir |
| البلاتين أو البلاتينيوم | Pt |
| الذهب | Au |
| الزئبق | Hg |
| الثاليوم | Tl |
| الرصاص | Pb |
| البزموت | Bi |
| البولونيوم | Po |
| الأستاتين | At |
| الرادون | Rn |
الدورة السابعة
| اسم العنصر | رمز العنصر |
| الفرانسيوم | Fr |
| الراديوم | Ra |
| اللورنسيوم | Lr |
| الرذرفورديوم | Rf |
| الدبنيوم | Db |
| السيبورجيوم | Sg |
| البوريوم | Bh |
| الهاسيوم | Hs |
| المايتنريوم | Mt |
| الدارمشتاتيوم | Ds |
| الروينتجينيوم | Rg |
| الكوبرنيسيوم | Cn |
| نيهونيوم | Nh |
| الفليروفيوم | Fl |
| الموسكوفيوم | Mc |
| ليفرموريوم | Lv |
| تينيسين | Ts |
| الرادون أو غانيسون | Og |
أسماء عناصر الجدول الدوري بالإنجليزي
| Symbol | Name |
| H | Hydrogen |
| He | Helium |
| Li | Lithium |
| Be | Beryllium |
| B | Boron |
| C | Carbon |
| N | Nitrogen |
| O | Oxygen |
| F | Fluorine |
| Ne | Neon |
| Na | Sodium |
| Mg | Magnesium |
| Al | Aluminium |
| Si | Silicon |
| P | Phosphorus |
| S | Sulfur |
| Cl | Chlorine |
| Ar | Argon |
| K | Potassium |
| Ca | Calcium |
| Sc | Scandium |
| Ti | Titanium |
| V | Vanadium |
| Cr | Chromium |
| Mn | Manganese |
| Fe | Iron |
| Co | Cobalt |
| Ni | Nickel |
| Cu | Copper |
| Zn | Zinc |
| Ga | Gallium |
| Ge | Germanium |
| As | Arsenic |
| Se | Selenium |
| Br | Bromine |
| Kr | Krypton |
| Rb | Rubidium |
| Sr | Strontium |
| Y | Yttrium |
| Zr | Zirconium |
| Nb | Niobium |
| Mo | Molybdenum |
| Te | Technetium |
| Ru | Ruthenium |
| Rh | Rhodium |
| Pd | Palladium |
| Ag | Silver |
| Cd | Cadmium |
| In | Indium |
| Sn | Tin |
| Sb | Antimony |
| Te | Tellurium |
| I | Iodine |
| Xe | Xenon |
| Cs | Caesium |
| Ba | Barium |
| Lu | Lutetium |
| Hf | Hafnium |
| Ta | Tantalum |
| W | Tungsten |
| Re | Rhenium |
| Os | Osmium |
| Ir | Iridium |
| Pt | Platinum |
| Au | Gold |
| Hg | Mercury |
| Tl | Thallium |
| Pb | Lead |
| Bi | Bismuth |
| Po | Polonium |
| At | Astatine |
| Rn | Radon |
| Fr | Francium |
| Ra | Radium |
| Lr | Lawrencium |
| Rf | Rutherfordium |
| Db | Dubnium |
| Sg | Seaborgium |
| Bh | Bohrium |
| Hs | Hassium |
| Mt | Meitnerium |
| Ds | Darmstadtium |
| Rg | Roentgenium |
| Cn | Copernicium |
| Nh | Nihonium |
| Fl | Flerovium |
| Mc | Moscovium |
| Lv | Livermorium |
| Ts | Tennessine |
| Og | Oganesson |
أسماء العناصر الجديدة في الجدول الدوري
أسماء العناصر الجديدة في الجدول الدوري هي: يهونيوم (Nh)، موسكوفيوم (Mc)، تينيسين (Ts)، أوجانيسون (Og)، حيث تمّت إضافتها إلى الجدول الدوري بشكل رسمي عام 2016، وتمّت تسميتها بواسطة الاتحاد العالمي للكيمياء التطبيقية والبحتة، وجميعها عناصر مشعّة، وغير مستقرة، إضافةً إلى أنها ذات عمر قصير جداً لا يتعدى جزءاً واحداً من الثانية، فيما قد يكون أكثر شيء ملفت للنظر في هذه العناصر هو درجة عدم استقرارها، حيث إنها جميعاً عناصر مشعة، ذات فترة نصف حياة قصيرة جداً تبلغ جزءاً من الثانية، والجدير بالذكر أنّه لم يتم العثور على هذه العناصر في الطبيعة، وتمّ اكتشافها فقط بالمختبرات عن طريق الأبحاث المتتابعة، إلّا أنّه لا يوجد استخدام عملي لغاية اللحظة، وربما تساعدنا في اكتشاف عناصر أخرى مهمّة في المستقبل القادم.
مجموعات الجدول الدوري
ما هي المجموعات
مجموعات الجدول الدوري هي الأعمدة في الجدول الدوري؛ ويطلق اسم العائلة على عناصر المجموعة الواحدة، وتشترك في خصائصها الكيميائية، والفيزيائية؛ مثال على ذلك أنّ عناصر المجموعة الأولى فيما عدا الهيدروجين يطلق عليها اسم الفلزات القلوية، ويُطلق اسم الفلزات القلوية الترابية على عناصر المجموعة الثانية، إضافةً إلى اسم الهالوجينات الذي يطلق على عناصر المجموعة السابعة عشر فتسمى الهالوجينات، أيضاً عناصر المجموعة الثامنة عشر يطلق عليها اسم بالعناصر النبيلة.
تتشابه عناصر المجموعة الواحدة في العمود الواحد من الجدول الدوري، والتي لها نفس النشاط الكيميائي؛ وذلك لأنها تمتلك نفس عدد الإلكترونات في المدار الأخير (إلكترونات التكافؤ)، وعند التحرك من الأعلى للأسفل ضمن المجموعة الواحدة في الجدول الدوري؛ فإن خصائص العناصر تتغيّر؛ بحيث يزداد نصف قطر الذرة، وتقل طاقة التأين، وتقل الكهروسلبية، وذلك لكل عنصر.
أرقام المجموعات في الجدول الدوري
عناصر المجموعة الأولى
يطلق عليها A1، وتحتوي المجموعة الأولى من الجدول الدوري على إلكترون واحد في غلافها الفرعي الخارجي، وتتضمن المجموعة الأولى الهيدروجين والفلزات القلوية، والتي تتميز بأنها أقل كثافة من الفلزات الأخرى، ولها أكبر نصف قطر ذري من العناصر الموجودة في نفس دورتها، ولها طاقة تأين منخفضة، وكهرسلبية منخفضة، وعناصر هذه المجموعة هي: الهيدروجين، والليثيوم، والصوديوم، والبوتاسيوم، والروبيديوم، والسيزيوم، بالإضافة إلى عنصر الفرانسيوم.
عناصر المجموعة الثانية
يطلق عليها A2، وتحتوي عناصر المجموعة الثانية على إلكترونين في غلافها الفرعي الخارجي، ويطلق عليها اسم مجموعة الفلزات الترابية القلوية، والتي تمتاز بقدرتها على تشكيل كاتيونات ثنائية التكافؤ بسهولة، كما أن لها تقارب منخفض للإلكترون، وكهرسلبية منخفضة، إضافةً إلى ألوانها المميزة عند الاشتعال، وعناصر هذه المجموعة هي: البيريليوم، والمغنيسيوم، والكالسيوم، والسترونتيوم، والباريوم، أيضاً عنصر الراديوم.
عناصر المجموعة الثالثة
يطلق عليها 3A أو المجموعة 13، تسمى بمجموعة البورون لأن جميع العناصر في هذه المجموعة فلزات فيما عدا عنصر البورون فهو شبه فلز. تحتوي عناصر هذه المجموعة على ثلاثة إلكترونات في غلافها الإلكتروني الخارجي، وتتكون هذه المجموعة من ستة عناصر هي: البورون، الألمنيوم، الجاليوم، الإنديوم، الثاليوم، أيضاً عنصر النيهونيوم.
عناصر المجموعة الرابعة
يطلق عليها 4A، أو المجموعة 14، يطلق عليها اسم مجموعة الكربون، والتي تحتوي على مزيج من الفلزات، وأشباه الفلزات، واللافلزات، وتحتوي عناصر هذه المجموعة على أربعة إلكترونات في غلافها الفرعي الخارجي، وعناصر هذه المجموعة هي: الكربون، السيليكون، الجيرمانيوم، القصدير، الرصاص، أيضاً عنصر الفليروفيوم.
عناصر المجموعة الخامسة
يطلق عليها المجموعة 5A، أو المجموعة 15، وتسمى مجموعة النيتروجين، تحتوي هذه المجموعة على مزيج من الفلزات وأشباه الفلزات واللافلزات، ويحتوي كل من النيتروجين والفوسفور على خمسة إلكترونات في غلاف الإلكترون الخارجي، وعناصر هذه المجموعة هي: النيتروجين، الفسفور، الزرنيخ، الأنتيمون، البزموث, المسكوفيوم.
عناصر المجموعة السادسة
يطلق عليها المجموعة 6A، أو المجموعة 16، وتسمى أيضًا مجموعة الأكسجين، وتحتوي هذه المجموعة على مزيج من الفلزات وأشباه الفلزات واللافلزات، وتعتبر من المجموعات الانتقالية، كما تحتوي عناصر هذه المجموعة على ستة إلكترونات في غلافها الفرعي الخارجي، وعناصر هذه المجموعة هي: الأكسجين، الكبريت، السيلسنيوم، التيليريوم، البولونيوم، وعنصر الليفرموريوم.
عناصر المجموعة السابعة
يطلق عليها المجموعة 7A، أو المجموعة 17، وتسمى مجموعة الهالوجينات، وعناصر هذه المجموعة عبارة عن لافلزات، ميّزتها أنها شديدة التفاعل، والجدير بالذكر أنّ هذه هي المجموعة الوحيدة في الجدول الدوري التي تحتوي على عناصر في جميع حالات المادة الثلاث في درجة حرارة الغرفة وضغطها، مثلاً عنصر الفلور وعنصر الكلور غازات، وعنصر البروم عبارة عن سائل، وعنصر اليود مادة صلبة.
تشترك عناصر هذه المجموعة في الخصائص الكيميائية، مثل الكهرسلبية العالية للغاية، وتتفاعل بشدة، لكنها تُظهر خواصًا فيزيائية مختلفة عن بعضها البعض، كما تحتوي عناصرها سبعة إلكترونات تكافؤ في غلافها الأخير، وعناصر هذه المجموعة: الفلور، الكلور، البروم، اليود، الأستاتين، وعنصر التينيسين.
عناصر المجموعة الثامنة
يطلق عليها 8A، أو المجموعة 18، وتُعرف عناصر هذه المجموعة باسم الغازات النبيلة، وعادة ما تكون هذه الغازات غير متفاعلة (خاملة)، وتحتوي الغازات النبيلة على غلاف إلكتروني خارجي مكتمل فيه ثمان إلكترونات، ولديها كهرسلبية منخفضة جدًا أو تقارب إلكتروني. عناصر هذه المجموعة هي: الهيليوم، النيون، الآرجون، الكريبتون، الزينون، الرادون، وعنصر الأوغانيسون.
مجموعات الجدول الدوري تبعاً لدرجة السلوك والخصائص الفلزية
الفلزات في الجدول الدوري
تتميّز المواد الفلزّية (Metals) بمرونتها، وقابليتها للطرق والتشكيل، وتعّرف بلمعانها، أيضاً جودتها في توصيل الحرارة والكهرباء، وتُشكل الجزء الأكبر من العناصر الموجودة في القشرة الأرضية، والماء، والغلاف الجوي، وجسم الإنسان.
تشكّل الفلزّات 80% من العناصر الموجودة في الجدول الدوري، يبلغ عددها 87 عنصراً، ولها العديد من الخصائص المميزة، ومنها ما يلي:
- تمتلك نقطة انصهار عالية.
- توجد في الحالة الصلبة في أغلب الأوقات ولها نفس درجة حرارة الغرفة، باستثناء عنصر الزئبق؛ فيكون سائلاً.
- يمكن تآكلها وتأكسدها أثناء تعرضها لمياه البحر والهواء.
- تفقد الإلكترونات بسهولة.
- ليّنة ومرنة.
- يمكن ثنيها وتشكيلها وسحبها.
- تتميّز معظم عناصر الفلزّات في الجدول الدوري بأنها عالية الكثافة، باستثناء عنصر الليثيوم، والبوتاسيوم، والصوديوم.
مجموعات العناصر الفلزية في الجدول الدوري
- الفلزات القلوية (Alkali Metals): هي عناصر المجموعة الأولى في يسار الجدول الدوري، وتتميّز بكثافتها المنخفضة مقارنةً مع العناصر الفلزيّة الأخرى، أيضاً شدّة تفاعلها التي تساعد على تواجدها على شكل مركبات في الطبيعة، وتمتلك هذه العناصر عدد تأكسد يساوي (+1)، من الأمثلة عليها: الليثيوم (Li)، والصوديوم (Na)، والبوتاسيوم (K)، والروبيديوم (Rb)، والهيدروجين (H) الذّي يتميّز عن باقي العناصر بتواجده نقياً في الطبيعة على شكل غاز الهيدروجين؛ والذي يُعتبر عنصر لافلزي في درجة حرارة وضغط الغرفة.
- الفلزات القلوية الترابية (Alkaline Earth Metals): تتواجد في المجموعة الثانية من الجدول الدوري، وتتواجد في الطبيعة على شكل مركّبات؛ حيث إنّها سريعة في التفاعل، ولكن بشكل أقل من الفلزّات القلوية، وتمتلك عدد تأكسد يساوي +2، وتضم هذه المجموعة: البريليوم (Be)، والمغنيسيوم (Mg)، والكالسيوم (Ca)، والسترونتيوم (Sr)، والباريوم (Ba)، والراديوم (Ra).
- الفلزات الأساسية (Basic Metals): هي من العناصر الموصلة للحرارة والكهرباء، ومن الأمثلة عليها: الألومنيوم (Al)، والغاليوم (Ga)، والانديوم (In)، والثاليوم (Tl)، والرصاص (Pb).
- الفلزات الانتقالية (Transition Metals): تتعرّض إلى العديد من حالات الأكسدة المتعدّدة، وينتج عنه ألوان مُعقّدة، يعود ذلك لامتلائها بشكلٍ جزئي بإلكترونات (d) أو (f)، مما يؤدي إلى وجود بعض العناصر بصورة نقية كالذهب والفضة، أو على شكل مركبات الأكتينيدات، واللانثانيدات، ومن أشهر عناصر هذه المجموعة: التيتانيوم (Ti)، والكروم (Cr)، والمنغنيز (Mn)، والحديد (Fe)، والنيكل (Ni)، والنحاس (Cu)، والزنك (Zn)، والزئبق (Hg).
استخدامات العناصر الفلزية
- الأدوات المنزلية: صناعة الأفران، وغسالات الأطباق، وغسالات الملابس، والمكانس الكهربائية، والخلاطات، والمضخات، وغيرها.
- أدوات تحضير الأغذية وحفظها: مثل الميكروويف، والأفران، والثلاجات، والمجمدات.
- الأجهزة الإلكترونية: مثل أجهزة الكمبيوتر والتلفزيون، والراديو، والآلات الحاسبة، وأجهزة الأمان.
- البناء: صناعة المسامير، والهياكل المعدنية الصلبة.
- وسائل النقل: صناعة السيارات، والحافلات، والشاحنات، والقطارات، والسفن، والطائرات.
- الاتصالات: كالأقمار الصناعية، وصناعة الصواريخ ومكوك الفضاء.
- الطاقة الكهربائية: مثل الغلايات، والتوربينات، والمولدات، والمحولات، وخطوط الطاقة، والمفاعلات النووية، وآبار النفط، وخطوط الأنابيب.
- المجال الطبي: الأطراف الصناعية مثل المفاصل، والذراعين وغيرها.
- الزراعة: صناعة الجرارات، وأدوات الحرث، وآلات جمع المحاصيل.
اللافلزات في الجدول الدوري
اللافلزات (بالإنجليزية Nonmetal) من موصلات الحرارة والكهرباء السيئة، والتي تمتاز بكونها غير قابلة للطرق والتشكيل، أيضاً تتواجد في الحالات الفيزيائية الثلاث الصلبة، والغازية، والسائلة في درجة حرارة الغرفة، بالإضافة إلى أنّها تمتاز بسهولة اكتسابها الإلكترونات نسبيًا.
تمتلك العناصر اللافلزية بعض الخصائص المميّزة، وهي أنّها تمتلك طاقة تأين وكهرومغناطيسية عالية، ولديها توصيل سيّء للكهرباء والحرارة، ولمعانها المعدني ضعيف إلى حد الانعدام، أيضاً هشاشة المواد الصلبة، وقلّة مرونتها وقابليتها للطرق، إضافةً إلى انخفاض درجة الانصهار والغليان مقارنةً بالفلزّات.
مجموعات العناصر اللافلزية
- العناصر الستة اليتيمة: البورون (B)، والنيتروجين (N)، والأكسجين (O)، والفسفور (P)، والكبريت (S)، والسلينيوم (Se).
- الهالوجينات (Halogens): توجد في المجموعة السابعة من الجدول الدوري، وتتواجد بجميع حالات المادة السائلة والصلبة والغازية، وتشمل العناصر: الفلور (F)، والكلور (Cl)، والبروم (Br)، واليود (I)، والأستاتين (At).
- الغازات النبيلة (Noble Gases): توجد في المجموعة الثامنة في الجدول الدوري باستثناء غاز الهيليوم، وتميل إلى عدم الارتباط بالعناصر الأخرى؛ ذلك بسبب احتوائها على ثمانية إلكترونات في غلافها الأخير، فهي تتواجد على شكل ذرّات فردية، ومن الأمثلة عليها: الهيليوم (He)، والنيون (Ne)، والأرغون (Ar)، والكريبتون (Kr)، والزينون (Xe)، والرادون (Rn).
تعتبر استخدامات العناصر اللافلزّية قليلة مقارنةً بالعناصر الفلزّية؛ على الرغم من أهمية عنصر الأكسجين للحياة، ومن الأمثلة على استخداماتها ما يلي: الطب والصيدلة، والمبرّدات، والأسمدة، والأحماض الصناعية. والليزر، والمصابيح.
الغازات الخاملة في الجدول الدوري
العناصر النبيلة أو الخاملة هي عبارة عن مجموعة من العناصر الكيميائية غير النشطة، والتي لا يمكن أن تتفاعل مع العناصر الأخرى، نظراً لارتفاع جهود تأينها، ولأنّ عدد الإلكترونات ممتلئ في غلافها الأخير؛ فإنها أقلّ العناصر ألفةً إلكترونيةً، وتقع العناصر الخاملة في المجموعة الثامنة في الجدول الدوري، وهي: الهيليوم He، والنيون Ne، والأرجون Ar، والكريبتون Kr، والزينون Xe، والرادون Rn، بالإضافة إلى عنصر جديد قيد الدراسة وهو الأنون أوكتيوم Uuo.
تشكّل العناصر النبيلة ما نسبته 1.29% من كتلة الغلاف الجوي، و1% من حجم الغازات المكوّنة له، ويحتلّ فيها غاز الأرجون النسبة الأكبر من هذا الحجم؛ إذ يشكّل 0.93% من الهواء الجوي، وتتوزّع النسبة المتبقيّة 0.08% على بقية الغازات الخاملة، ومنخصائص العناصر الخاملة:
- لا تمتلك أيونات موجبة أو سالبة.
- غازاتها لا لون لها، ولا رائحة.
- يصعب إسالتها بسبب انخفاض درجاته الحرجة.
- موجودة في الطبيعة على شكل ذرّات منفردة أحاديّة الذرة.
- تكون غازات في ظروف الغرفة أو الظروف العادية من الضغط والحرارة.
- تعتبر عناصر خاملة ومستقرة، بسبب امتلاكها ثمانية إلكترونات تكافؤ في مدارها الأخير (عدد مكتمل من الإلكترونات في المدار الأخير)، باستثناء عنصر الهيليوم الذي يحتوي المستوى الخارجي الأخير له على إلكترونين فقط.
- لا تنتج أيّ مركبات أخرى، إلا في ظروف خاصّة جداً من الحرارة والضغط وغيرها.
- تُستخلص من الهواء، من خلال عملية التقطير.
- قوى التجاذب بين ذراتها الداخلية ضعيفة.
- درجات غليانها، وذوبانها، ولزوجتها منخفضة جداً.
- تزداد كتلتها الذريّة، بالاتجاه من أعلى إلى أسفل المجموعة في الجدول الدوريّ.
- تذوب في الماء، وتزداد قابليتها للذوبان بالاتجاه من أعلى إلى أسفل المجموعة، وقلّ نشاطها الكيميائي بسبب زيادة طاقة التأيّن.
- من استخدامات العناصر الخاملة استخدام الهيليوم في تعبئة هواء المناطيد، والبالونات؛ لأنّ وزنه أخفّ من الهواء، أيضاً لا ينفجر أو يحترق، وفي بيئات تنمية البلورات الدقيقة تحت ظروف حساسة، وفي ضغط الوقود الغاز المسال.
- يستخدم خليط الهيليوم مع الأكسجين والنيتروجين، لملء قوارير هواء التنفس الخاصّة بالغواصين في أعماق البحار.
- يستخدم النيون والكريبتون في إضاءة المصابيح في الحانات ودور السينما، أيضاً يستخدم الزينون لتأشير مسارات الطيران، كما يستخدم في مصابيح الغاز بسبب لون الأبيض الساطع.
- يستخدم الأرجون كغاز في تعبئة مصابيح الإنارة، بسبب عدم تفاعله مع السلك المعدني المتوهّج، عند درجات حرارة مرتفعة، كما يستخدم في عمليات اللحام، كغاز عازل لمنطقة اللحام عن البيئة المحيطة. يستخدم الرادون في علاج بعض أنواع السرطانات
- يستخدم الهيليوم والأرجون في لحام بعض الفلزات، مثل المغنيسيوم، والألومنيوم لمنع تأكسدها.
المعادن في الجدول الدوري
من الخصائص الفيزيائية التي تتمتع بها العناصر الفلزّية التي تفقد إلكتروناتها بسهولة أنها معدنية، وهي خاصية الطبيعية يمتاز بها العنصر دون تدخل بشري، ومن هذه الخصائص: اللمعان، والبريق، والتوصيل الكهربائي والحراري بشكل جيد.
تعتبر جميع عناصر الفلزات صلبة باستثناء عنصر الزئبق؛ فهو سائل لزج، وتحتاج إلى درجة انصهار عالية، إضافةً إلى أنّ كثافتها عالية، وقابلة للطرق والسحب، أمّا خصائصها الكيميائية تتآكل وتصدأ سريعاً؛ ومنها الحديد، والفضة.
استخدامات الجدول الدوري
تكمن أهمية الجدول الدوري للعناصر في دراستها ودراسة خصائصها الفيزيائية والكيميائية المختلفة، والتي تختلف باختلاف المجموعات به، فعلى سبيل المثال يحتاج الطالب إلى معرفة خصائص عنصر معيّن، أيضاً العالم يحتاج إلى معرفة كيفية تفاعل عنصر مع عنصر آخر، كل هذا يمكن التعرف عليه من خلال خواص المجموعة بكل عنصر في الجدول الدوري، إضافةً إلى أنّه يُمكن استخدام الجدول الدوري لمعرفة عدد كبير من المعلومات الخاصة بالعناصر ومنها: رمز العنصر، وعدده الذري، وكتلته الذرية، وغيرها من المعلومات الأخرى التي تعود إلى العنصر من الخصائص الكيميائية والفيزيائية.
يتكون الجدول الدوّري من 120 مربعاً؛ كل منها يحتوي على عنصر من عناصر الجدول الدوري، من كل مربع خاص بالعنصر يُمكن معرفة المعلومات الآتية:
- رمز العنصر: هو اختصار لاسم العنصر الذي يُشير إليه.
- العدد الذري: هو عدد البروتونات التي تحتويها ذرة واحدة من ذرات العنصر، ويصّب الاهتمام بالبروتونات؛ ذلك لأنّها تميّز كل العنصر عن الآخر، في حين أنّ تغيُر عدد الإلكترونات والنيوترونات في عنصر معين لا يُغير نوعه.
- الكتلة الذرية: هي متوسط كتلة العنصر بالنسبة لنظائره.
- اسم العنصر: هو الاسم العلمي للعنصر.
توجد الكثير من استعمالات الجدول الدوري منها: المدارس والجامعات، والأبحاث العلميّة للتعرّف على صفات العناصر الكيميائية والفيزيائية؛ حيث يُسهِّل على الطلاب وطلبة العمل تقييم حالة عنصر من خصائصه، ولا زال العلماء حتى هذا الوقت يحاولون اكتشاف عناصر جديدة، لإضافتها للعناصر الحاليّة في الجدول الدوري.
اهمية الجدول الدوري التفاعلي
- يمكن التعرف على البنية الالكترونية لذرة اللعنصر الكيميائي.
- يتم تحديد موقع العنصر في الدورة والمجموعة.
- التعرف على خصائص العناصر الكيميائية.
- يمكن من خلاله معرفة التفاعلات الكيميائية التي يمكن أن يدخلها العنصر الكيميائي.
- يمكن معرفة العدد الذري والكتلي لأي عنصر كيميائي في حالة معرفة رمزه الكيميائي.
التوزيع الالكتروني لجميع عناصر الجدول الدوري
كل غلاف من أغلفة الطاقة في ذرات العناصر ينقسم إلى مستويات فرعية عديدة، والتي تمتلئ بزيادة الرقم الذرّي للعناصر، وعدد إلكترونات الغلاف الأخير (إلكترونات التكافؤ) يحدد إلى أي دورة يتنتمى العنصر، ويعود الترتيب التالي للعالم أوغانيسون.
| 7p6 | 6d10 | 5f14 | 7s2 | 6p6 | 5d10 | 4f14 | 6s2 | 5p6 | 4d10 | 5s2 | 4p6 | 3d10 | 4s2 | 3p6 | 3s2 | 2p6 | 2s2 | 1s2 |
يتم توزيع الإلكترونات بناءً على المستويات الفرعية بالترتيب التالي:
- s=2.
- p=6.
- d=10.
- f=14.
العناصر تميل لأن تكون متشابهة في مجموعات الجدول الدوري، والإلكترونات في مستويات الطاقة الخارجية هي التي تحدد خواص العناصر الكيميائية، مثلاً العناصر التي تلي بعضها في مجموعة الجدول الدوري تكون متشابهة في خصائصها الفيزيائية، ومختلفة في كتلة كل منها، أيضاً العناصر التي تلي بعضها في دورة الجدول الدوري، يكون لها كتلة متشابهة، لكنها تختلف في خصائصها الفيزيائية.
طريقة حفظ الجدول الدوري
- طباعة نسخ من الجدول الدوري، واستخدام كل نسخة عند البدء في المذاكرة والحفظ.
- تقسيم الجدول إلى أقسام صغيرة حسب الأعمدة أو الصفوف، أو الوزن الذري، إلخ.
- الاستمرار في تعلم القليل كل يوم يساعد على التذكّر.
- تحديد العناصر الفريدة من نوعها.
- تكرار العناصر دائماً، وتكرارها باستمرار.