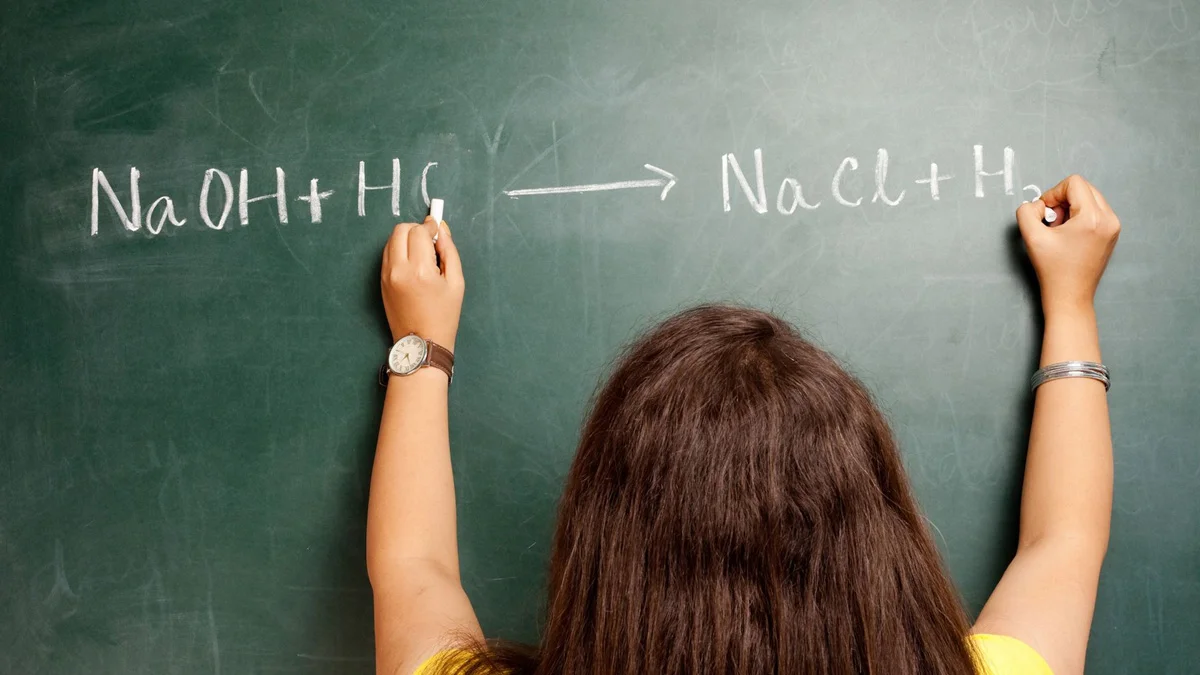جدول المحتويات
المعادلات الكيميائية هي طريقة للتعبير عن كتابة التفاعل الكيميائي عن طريق استخدام رموز كيميائية وصيغ، وتكون المعادلة على شكل مواد داخلة في التفاعل ومواد خارجة منه، ويوجد عدّة أنواع للمعادلات الكيميائية تختلف باختلاف نوع التفاعل والظروف الموجودة بالتفاعل الكيميائي، ويُقصد بوزن المعادلات الكيميائية توضيح عدد الجزيئات الداخلة والخارجة من التفاعل الكيميائي لكل عنصر من عناصر التفاعل عن طريق عدّ عدد الذرات وموازنتها.
يتحدث المقال عن المعادلات الكيميائية، ويشمل:
- المعادلات الكيميائية.
- أنواع المعادلات الكيميائية.
- خصائص المعادلة الكيميائية.
- وزن المعادلات الكيميائية.
- حسابات المعادلات الكيميائية.
- المعادلة الكيميائية الحرارية.
- رموز المعادلات الكيميائية.
- معادلة الماء الكيميائية.
المعادلات الكيميائية
المعادلات الكيميائية هي طريقة للتعبير عن كتابة التفاعل الكيميائي باستخدام رموز كيميائية وصيغ، وتكون المعادلة على شكل مواد داخلة في التفاعل وأخرى خارجة منه، بالإضافة إلى أنّها تبيِّن الإلكترونات المفقودة والمكتسبة من كل ذرة عنصر من العناصر الموجودة في التفاعل الكيميائي، والمعادلة الكيميائية أيضاً توضِّح التغييرات التي تحدث للمواد المتفاعلة بسبب ظروف التفاعل المختلفة، وتبيِّن حاجة التفاعل للضغط والحرارة والعوامل المساعدة لإتمامه بشكل تامّ.
أنواع المعادلات الكيميائية
يوجد عدّة أنواع للمعادلات الكيميائية تختلف باختلاف نوع التفاعل والظروف الموجودة بالتفاعل الكيميائي، وفيما يلي بيان لأنواع المعادلات الكيميائية:
- تفاعلات التأكسد والاختزال (بالإنجليزيّة: Oxidation-Reduction Reactions):
- يطلق عليها اسم تفاعلات الأكسدة والإرجاع، وهو من أكثر أنواع التفاعلات الكيميائيّة انتشارً وشيوعاً في حياتنا اليومية، وهذه التفاعلات تحدث في العديد من الوظائف الحيوية الأساسية مثل عملية التنفس والبناء الضوئي وغيرها من العمليات الحيوية، ففيها يتم تغيير عدد إلكترونات الجزيء أو الذرة أو الأيون الذي يكسب أو يفقد إلكترونات بسبب انتقال الإلكترونات بين نوعين من المواد في هذا التفاعل، ومعظم هذه التفاعلات تكون عبارة عن عمليات نقل للأكسجين أو الهيدروجين أو الإلكترون.
- عملية الأكسدة تعتمد على فقدان الإلكترونات الذي يعني الزيادة في الشحنة الموجبة، ولكن العكس يحدث في عملية الاختزال التي يكتسب فيها العنصر إلكترونات، وهذا يعني الزيادة في الشحنة السالبة، و مثال على هذا التفاعل:
Zn + Cu(+2) → Zn(+2) + Cu
- في التفاعل الكيميائي السابق يتأكسد عنصر الزنك ويفقد إلكترونين، ويتم اختزال عنصر النحاس ويكسب إلكترونين.
- في تفاعلات التأكسد والاختزال يتغير عدد أكسدة الجزيء أثناء التفاعل، ويفقد الجزيء إلكترونات أو يكسبها بنقل الأكسجين أو الهيدروجين أو الإلكترون.
- تفاعلات الاتحاد أو الضمّ (بالإنجليزيّة: Combination Reactions): هي تفاعل يتحدّ فيه عنصرين مختلفين أو أكثر من عنصرين، وينتج عن هذا الاتحاد عنصر جديد، ويطلق عليها اسم تفاعلات التصنيع أو التخليق لأنّ المادة التي تنتج عنها تكون مادة جديدة، وهذا النوع من التفاعلات يحدث بين عنصرين أو أكثر، أو بين عنصر ومركب، أو بين مركبين، وفيما يلي مثال على هذا النوع من التفاعلات الكيميائية:
- اتحاد عنصر الصوديوم والكلور من أجل إنتاج عنصر جديد؛ واسمه كلوريد الصوديوم “ملح الطعام” كما في المعادلة التالية:
2Na + Cl2 → 2NaCl
- تفاعلات التفكك أو التحلل (بالإنجليزية: Decomposition reaction): نوع من التفاعلات البسيطة التي يتفكك فيها عنصر واحد إلى عنصرين أو أكثر، وهذا النوع من التفاعلات الكيميائية موجود في حياتنا اليومية، ومن الأمثلة عليه تحلل حمض الكربونيك داخل المشروبات الغازية، وتبيِّن المعادلة التالية مثال على هذا التفاعل الكيميائي تفكك بيروكسيد الهيدروجين إلى عنصرين ماء وأكسجين:
H2O2 → H2O + O2
- تفاعل الإزاحة الأحادية (بالإنجليزيّة: Single Replacement Reaction):
- في هذا النوع من التفاعلات الكيميائية يحل عنصر مكان عنصر آخر داخل مركب معين؛ ولهذا يتم تسميته بتفاعل الاستبدال، وهذا التفاعل يحدث بشكل دائم بين سائل مركب وعنصر نقي، وينتج عن التفاعل مركب مائي وعنصر نقي جديدين، وتبيّن المعادلة التالية كيفية حدوث هذا التفاعل:
AgNo3 (aq) + Cu (s) → CuNo3 (aq) + Ag
- يدل الرمز “s” على أنّ المادة صلبة “عنصر نقي” والرمز “aq” يدل على أنّ المركب سائل، ونتيجة هذا التفاعل كانت باستبدال عنصر الفضة في السائل بعنصر النحاس ونتج عن التفاعل مركب جديد وعنصر نقي جديد.
- تفاعلات الإزاحة الثنائية (بالإنجليزية: Double Displacement Reaction):
- يكون هذا النوع من التفاعلات الكيميائيّة بين مركبين من المواد المتفاعلة، يتم في هذا التفاعل تبادل الأيونات بين المركبين من أجل إنتاج مركبين جديدين من نوعهما، ولهذا فهو غالب الحدوث بين المركبات الأيونيّة، ويتكون روابط أيونيّة تساهميّة بين المواد المتفاعلة تكون نفس هذه الروابط في المواد الناتجة، ولهذا النوع من التفاعلات اسم آخر هو “الاستبدال الثنائي” أو “تفاعلات التحلل الثنائي”، وينقسم هذا النوع من التفاعلات إلى ثلاثة أقسام هي:
- تفاعلات الترسيب.
- تفاعلات التعادل.
- تفاعلات إطلاق الغازات.
- فيما يلي مثال على تفاعلات الترسيب:
AgNo3 + NaCl → AgCl (s) + NaNo3
- في هذا التفاعل بين كلوريد الصوديوم “ملح الطعام” مع نترات الفضة كان الناتج “راسب كلوريد الفضة”.
- تفاعلات التحلُّل المائي (بالإنجليزيّة: Hydrolysis):
- يعتمد هذا النوع من التفاعلات على وجود الماء في المواد المتفاعلة، وصيغته الكيميائية “H2O”، وهذا النوع من التفاعلات العكسيّة الذي تتحد فيه المواد التي الناتجة لإعطاء مواد متفاعلة من حديد، ويصل التفاعل إلى التوازن الكيميائي، ولهذا تعتبر المواد الناتجة في التفاعل مركبات متعادلة، وفي هذا التفاعل يحدث تكسير للرابطة الكيميائية الموجودة في جزيء الماء لينقسم لأيون الهيدروجين وأيون الهيدروكسل “OH”، ويكسر الماء رابطة المركب الكيميائي الآخر الموجود داخل المواد المتفاعلة.
- يوجد ثلاث أقسام لتفاعلات التحلل المائي، وهي:
- التحلل المائي للأملاح.
- التحلل المائي للأحماض.
- التحلل المائي للقواعد.
- تفاعل التحلل المائي يشمل مركبات عضوية من خلال تفاعل الماء مع إستر حمض الكربوكسل، وتنتج رابطة تساهمية بين ذرة الأكسجين الموجود في جزيء الماء وبين ذرة الكربون في الإستر، وفيما يلي مثال على هذا التفاعل مع الإستر:
CH3COOCH3 + H2O → CH3COOH + CH3OH
- تفاعلات التعادل (بالإنجليزيّة: Acid-Base Reactions):
- تفاعلات التعادل تكون بين الحمض والقاعدة، ويتواجد هذا التفاعل في الكثير من الأمور في حياتنا اليومية وخاصّةً في الطهي والتنظيف، والحمض يصنّف لحمض قويّ أو ضعيف، والقاعدة تصنّف لقاعدة قويّة أو ضعيفة، وتفاعل التعادل يكون بين حمض قويّ أو متوسط القوّة مع قاعدة قويّة أو متوسطة القوّة لينتج عنه الماء والملح، ومن الأمثلة عليه:
HCL + NaOH → NaCl + H2O
- يعتبر HCL حمض قويّ، و NaOH قاعدة قوية، وبناءً على تعريف العالم أرهينيوس (بالإنجليزيّة: Arrhenius) والعالمين بروستيد ولوري، فإنّ الحمض مادّة تذوب في الماء ليتم إنتاج أيونات “+H”، والقاعدة مادة تذوب في الماء ينتج عنها أيونات الهيدروكسيد “OH-“.
خصائص المعادلة الكيميائية
يمكن تعريف خصائص المعادلة الكيميائية على أنّها سلوك أو تصرّف تقوم به المادة أثناء التفاعل بسبب التغيير الكيميائي الذي يحدث لها، ويكون هذا السلوك أثناء التفاعل الكيميائي أو بعد انتهاؤه، ومن أهم خصائص المعادلة الكيميائية للمواد ما يلي:
- حرارة الاحتراق (بالإنجليزيّة: Heat of Combustion): هذه الخاصيّة الكيميائية تعبِّر عن مقدار الطاقة التي تصدر على شكل حرارة عند حرق المادّة بالأكسجين، فمثلاً السعرات الحرارية تتحول إلى طاقة في جسم الإنسان، بالإضافة إلى حرق الوقود بكافّة أنواعه.
- القابليّة للاشتعال (بالإنجليزيّة: Flammability): هذه الخاصيّة تبيّن مدى سهولة تعرّض شيء ما للاشتعال والاحتراق، ولا يمكن تحديدها بالنظر وإنّما بإجراء التجارب على المواد، وهذه الخاصيّة مفيدة في العديد من المجالات مثل قوانين البناء والتخزين ومتطلّبات التأمين.
- السُميّة (بالإنجليزيّة: Toxicity): هذه الخاصيّة تحدّد مقدار الضرر الذي من الممكن إلحاقه على الكائن الحي بسبب المادة ذات السمّية، ومن الأمثلة على هذه المواد ذات الخصائص السميّة الرصاص شديد السميّة وذو التأثير الضارّ على جميع أعضاء جسم الإنسان مثل القلب والجهاز العصبي والكلى، بالإضافة إلى الزئبق، وغاز الكلور.
- القدرة على التأكسد (بالإنجليزيّة: Ability to oxidize): هذه الخاصيّة تؤثر في رقم الأكسدة الذي يتعلق بأحد المواد، ومن الأمثلة عليها الصدأ الذي يحدث نتيجة لتعرّض الحديد للأكسجين، بالإضافة إلى تغيّر لون التفاح بعد تقطيعه لقطع صغيرة.
- النشاط الإشعاعي (بالإنجليزيّة: Radioactivity): هذه الخاصيّة تعبّر عن الإشعاع المنبعث من داخل نواة غير مستقرّة لإحدى الذرات، ومن الأمثلة على العناصر التي لها هذه الخاصيّة؛ الهيدروجين، والكربون، والكوبالت، والكالسيوم، والحديد، والبريليوم.
- الاستقرار الكيميائيّ (بالإنجليزيّة: Chemical stability): أو ما تسمى بالاستقرار الديناميكي الحراري داخل النظام الكيميائي، وهذه الخاصيّة تدل على حالة الاستقرار التي يتم تشكيلها عند أقل مستوى من الطاقة للنظام الكيميائي.
- عمر النصف (بالإنجليزيّة: Half-life): هذه الخاصيّة تعبّر عن الوقت الذي تحتاجه المادة الكيميائية الأصلية لكي تتحلل.
- المحتوى الحراري للتكوين (بالإنجليزيّة: Enthalpy of Formation): تعبّر هذه الخاصيّة عن كميّة الحرارة الممتصة أو المنبعثة، والتي تنشأ عند تكوين المواد النقيّة من العناصر الأساسية في ظروف الضغط الثابت.
- التفاعليّة (بالإنجليزيّة: Reactivity): هذه الخاصيّة تدل على قدرة الماء على الاندماج مع المواد الأخرى كيميائيّاً، ويوجد منها نوعين؛ الأول شديد التفاعل، والثاني بسيط التفاعل.
- الكهروسلبية (بالإنجليزيّة: Electronegativity): هذه الخاصيّة تدل على حالة من زيادة رغبة الذرات في جذب إلكترونات الرابط، وعند تفاعل ذرتين لهما نفس المقدار من الكهروسلبيّة فهذا يؤدي إلى تشاركهم في الإلكترونات وإنتاج رابطة تساهميّة، وفي حال كان هناك فرق كبير في الكهروسلبية فستنشأ رابطة أيونيّة.
وزن المعادلات الكيميائية
يُقصد بوزن المعادلات الكيميائية توضيح عدد الجزيئات الداخلة والخارجة من التفاعل الكيميائي لكل عنصر من عناصر التفاعل عن طريق عدّ عدد الذرات وموازنتها، ويجب أن يكون عدد الذرات الداخلة لكل عنصر مساوياً لعدد ذرات العناصر الخارجة، وفيما يلي مثال على وزن المعادلة الكيميائية:
CH4 + O2 → CO2 + H2O
المعادلة السابقة غير موزونة و لوزنها نقوم بالخطوات الآتية:
- بدايةً نقوم بعدّ الذرات الداخلة في التفاعل لكل عنصر، وأول عنصر هو الكربون والموجود في جزيء الميثان CH4، والعنصر الثاني هو الهيدروجين الموجود في جزيء الميثان أيضاً.
- الرقم الموجود على يمين رمز الهيدروجين هون 4، وهذا يدل على وجود 4 ذرات من الهيدروجين المرتبطة مع الكربون، وذرة كربون واحدة معها ليتشكّل جزيء الميثان CH4.
- نعدّ ذرات الأكسجين ورمزه O الداخلة في التفاعل ونجد أنّها ذرتان، وجزيء غاز الأكسجين يتواجد على شكل ذرتين مرتبطتين في الطبيعة.
- نعدّ الذرات الخارجة من التفاعل وتكون بعد السهم، ففي جزيء ثاني أكسيد الكربون CO2 يوجد ذرة كربون واحدة وذرتيّ أكسجين.
- نعدّ ذرات جزيء الماء H2O الخارج من التفاعل وفيه ذرتيّ هيدروجين وذرة أكسجين واحدة.
- ممّا سبق نلاحظ أنّ عدد الذرات لكل عنصر من العناصر الداخلة في التفاعل لا يساوي عدد الذرات الخارجة من التفاعل لنفس العنصر، والعنصر الوحيد الذي تساوت عدد ذراته الداخلة مع عدد ذراته الخارجة هو الكربون.
- عدد ذرات الأكسجين الداخلة يساوي 2، وعدد الذرات الخارجة منه يساوي 3.
- عدد ذرات الهيدروجين الداخلة يساوي 4، وعدد ذرات الهيدروجين الخارجة يساوي 2.
- نقوم بمضاعفة عدد بعض الجزيئات الموجودة في المعادلة السابقة حتى تتساوى عدد الذرات الداخلة والخارجة من التفاعل، ويصبح شكل المعادلة كما يلي:
CH4 + 2O2 → CO2 + H2O
- بهذا الشكل يصبح عدد ذرات الأكسجين الداخلة في التفاعل 4 ذرّات، وعدد الذرات الخارجة من التفاعل يساوي 3، ولمعادلة ذلك نقوم بإضافة رقم 2 ليسار جزيء الماء وتصبح المعادلة كما يلي:
CH4 + 2 O2 → CO2 + 2 H2O
- نلاحظ أن عدد ذرات الهيدروجين والكربون الداخلة للتفاعل مساوية لعدد ذرات الهيدروجين والكربون الخارجة من التفاعل، وبهذا أصبحت المعادلة موزونة.
ملاحظة: السبب في وزن المعادلات الكيميائية يكون بسبب أحد مبادئ العلوم الأساسيّة؛ وهو قانون حفظ المادة الذي ينصّ على: “المادة لا تموت ولا تفنى، كما لا تُخلق ولا تُستحدث من العدم، وإنّما تنتقل وتتغير من شكل إلى شكل آخر”، ولهذا ليس من الممكن حدوث تفاعل ينتج عنه مواد جديدة أو ذرات جديدة من العدم، ويجب أن يكون الناتج أحد المواد الداخلة في التفاعل، ولا يمكن لذرات أن تختفي من التفاعل، ويجب أن تظهر جميع الذرات بشكل كامل في نتيجة التفاعل كما كانت في مدخلات التفاعل.
حسابات المعادلات الكيميائية
للقيام بالحسابات التي تعتمد عليها المعادلة الكيميائيّة يجب اتباع الخطوات التالية:
- كتابة المعادلة الرمزيّة الموزونة.
- معرفة جميع نسب المولات للمواد الداخلة في التفاعل الكيميائي وللمواد الخارجة عن التفاعل الكيميائي.
- من الأفضل تحويل الكميات إلى مولات لتسهيل التعامل معها.
مثال على قراءة المعادلة الكيميائية:
2 Al + 3 Cl2 → 2 AlCl3
من الممكن قراءة المعادلة الكيميائية السابقة بطريقتين هما:
- 2 مول من ذرات “Al” تتفاعل مع 3 مول من جزيئات “Cl2“، وينتج عن التفاعل 2 مول من جزيئات AlCl3.
- 2 ذرة “Al” تتفاعل مع 3 جزيئات “Cl2” من أجل إنتاج جزيئين من المركب “AlCl3“.
يبيّن المثال التالي طريقة القيام بالحسابات الكيميائية كما في الخطوات السابقة:
- مثال: احسب عدد مولات الهيدروجين التي تلزم للتفاعل مع 42 غم من النيتروجين بناءً على المعادلة التالية:
3 H2 + N2 → 2 NH3
- الحل: الوزن الذري N = 14 ، H = 1:
M N2 = 2 * 14 = 28 gram / mol.
nN2 = m / M = 42 / 28 = 1.5 mol.
1 N2 ~ 3 H2
nN2 = (1.5 * 3) /1= 4.5 mol.
المعادلة الكيميائية الحرارية
المعادلة الكيميائية الحرارية التي يتم فيها تحديد التغيّر بالمحتوى الحراري، ويُقاس هذا التغيّر بالكيلوجول، وعند كتابة المعادلات الكيميائية الحرارية يتم مراعاة ما يلي:
- أعداد مولات المعادلة التي يتم الإشارة إليها عن طريق الأرقام الخاصّة بالتوازن.
- كتابة الحالة التي تخصّ المادة بالتفاعل لأنّ محتوى المادّة الحراري يتبع حالة المادة.
عند كتابة المعادلة الكيميائية الحرارية من الممكن إدراج الكمية التي تخصّ الحرارة مع المواد التي تفاعلت أو نتجت، ولقد قام العلماء بالاتفاق بشكل مسبق على كتابة محتوى الحرارة بجانب المعادلة على شكل مستقل.
أسئلة شائعة
ما هي رموز المعادلات الكيميائية؟
المعادلة الكيميائية هي تعبير رمزي للتفاعل الكيميائي، يتم استخدامها لكي يتم تلخيص التفاعل الكيميائي وتمثيله بشكل دقيق، ولكتابة المعادلة الكيميائية يجب أخذ الأمور التالية بالاعتبار:
- معرفة أسماء المواد المتفاعلة والمواد الناتجة للتعبير عنها لفظياً.
- معرفة صيغ المواد المتفاعلة والناتجة في سبيل التعبير عن التفاعل برموز، ويتم وضع صيغ المتفاعلات على اليسار والنواتج على اليمين، والفصل بين النواتج والمتفاعلات بسهم.
- تحديد حالة كل مادة من المتفاعلات والنواتج والتعبير عنها من خلال رموز يتم وضعها بعد الرموز بشكل مباشر بين أقواس بعد صيغة كل مادة من مواد التفاعل.
- هذه الرموز التي تعبِّر عن حالة المادّة هي:
- رمز “s” اختصار لكلمة “solid”، وتعني الحالة الصلبة.
- رمز “aq” اختصار لكلمة “aqueous”، وتعني محلول مائي.
- رمز “g” اختصار لكلمة “gas”، وتعني الحالة الغازية.
- رمز “l” اختصار لكلمة “liquid”، وتعني الحالة السائلة.
- الخطوة الأخيرة تكون بموازنة المعادلة الكيميائية من أجل تحقيق قانون حفظ المادّة.
ما هي معادلة الماء الكيميائية؟
الماء ينتج عن دمج غازيّ الهيدروجين مع الأكسجين عن طريق تفاعل كيميائي، ويحدث هذا بانفصال جزيء الهيدروجين H2 لذرتين، وكل واحدة منهما تندمج مع طرف من أطراف الأكسجين، وهذا يؤدي لتكوّن جزيء الماء H2O، وفيما يلي معادلة تفاعل الماء النقي التي تحتوي على نفس عدد الذرات من الهيدروجين والأكسجين قبل التفاعل الكيميائي وبعده، وهذا ما يتفق مع مبدأ دالتون الذي ينص على أنّ “ذرات العناصر الكيميائية تتحد مع بعضها بنسب عددية ثابتة”، والناتج من المعادلة التالية يكون الماء في حالته السائلة:
2 H2 + O2 → 2 H2O
من أبرز وأهم خصائص جزيء الماء ما يلي:
- يتميّز الماء بتواجده في حالات المادّة الثلاث؛ الصلبة، والسائلة، والغازيّة، وبهذا فهو واحد من أهم الموارد الموجودة على سطح الأرض وأكثرها انتشارً.
- ذرات الأكسجين في جزيء الماء تمتلك كهروسلبية عالية تساعدها في جذب الإلكترونات المشتركة مع الهيدروجين عن طريق روابطها التساهميّة، ونتيجة لهذا تبقى الإلكترونات حول مركز النواة مدّة أطول عندما يتم مقارنتها بالمدّة الذي تبقى فيه حول نواة ذرة الهيدروجين، وهذا ما يعطي للماء صفات قطبيّة.
- جزيئات الماء تحمل بنية جزيئيّة منحنيّة بسبب الطريقة التي ترتبط بها ذرة الأكسجين مع ذرتيّ الهيدروجين، وتتنافر الإلكترونات غير المشتركة والمشتركة عن بعضها لأبعد مسافة ممكنة بينهم، وينتج عن هذا التنافر الترتيب الجزيئي الأفضل بزاوية قيمتها 104.5 درجة بين روابط H — O داخل جزيء الماء، وهذا الترتيب يطلق عليه اسم “البنية الجزيئية رباعيّة السطوح” (بالإنجليزيّة: Tetrahedron).
الماء يتوّزع على سطح الأرض بصورة غير متساوية، وماء المحيطات يحتل النسبة الأكبر بحوالي 97% من إجمالي الماء على سطح الأرض، وتصل نسبة الماء العذب إلى 3% من إجمالي الماء على سطح الأرض، والماء العذب يتوزّع بين أكثر من مصدر كالآتي:
- 69 % من الماء العذب أنهار جليديّة.
- 30 % من الماء العذب مياه جوفيّة.
- أقل من 1 % من الماء العذب تتوزّع بين الأنهار والبحيّرات والمستنقعات، وبهذا نسبة الماء العذب الذي يصلح للاستهلاك البشري لا تتجاوز 1 % من إجمالي الماء، و 99 % من الماء الصالح للاستخدام البشري هو ماء جوفيّ.
بعض الأرقام والحقائق عن توزيع الماء على سطح الأرض وكميّاته كما يلي:
- إجمالي حجم الماء الكلي الموجود على سطح الأرض يصل إلى 1.4 مليار كم3، وهذا ما يساوي تريليون لتر من الماء.
- نسبة الماء التي تتواجد في الغلاف الجوي تقارب 12,900 كم3 أغلبها يكون بخار ماء.
- تصل كميّة إجمالي الماء الذي يتبخّر بشكل يومي للغلاف الجوي تقريباً إلى 1170 كم3.
يصل حجم الماء العذب الموجود والمخزّن في باطن سطح الأرض تقريباً إلى 8.4 مليون كم3، وبهذا الرقم فإنّه يتجاوز حجم المياه العذبة الموجودة على سطح الأرض على شكل أنهار جليديّة وبحيرات وأنهار.